Da história às aplicações. Da pilha à bateria de fluxo e até aonde mais poderemos chegar
 Autor: Gerhard Ett, Professor e Pesquisador do Centro Universitário FEI - Departamento de Engenharia Química - Laboratório de Engenharia Eletroquímica
Autor: Gerhard Ett, Professor e Pesquisador do Centro Universitário FEI - Departamento de Engenharia Química - Laboratório de Engenharia Eletroquímica
Resumo
As baterias são sistemas eletroquímicos de armazenamento de energia e, graças à evolução físico-química e dos materiais, hoje alcançam uma maior autonomia e durabilidade. Podem ser aplicadas em lugares antes não pensados, como na indústria 4.0, a nova revolução industrial que já vivemos, que necessita de sistemas autônomos de energia. Neste trabalho, apresentamos um review da história da arte das baterias e focamos nas novas baterias de fluxo. Elas possuem como vantagem, a rápida recarga (três minutos), alta estabilidade térmica e flexibilidade na instalação, que também as tornam atraentes ao novo sistema elétrico mundial.
Abstract
Batteries are electrochemical energy storage systems and thanks to the evolution of the Physical Chemistry and the materials and, today they achieve greater autonomy and durability. They can be applied in places previously unthinkable, as in industry 4.0, the new industrial revolution that we already live, which needs autonomous energy systems. In this work we present a state of art of the history of batteries and focusing on the new flow batteries. They have the advantage of fast recharging (three minutes) and high thermal stability and flexibility in installation, which also make them attractive to the new world electrical system.
CO-Autoras e Alunas de graduação do Centro Universitário da FEI do Departamento de Engenharia Química
Introdução
Um dos maiores desafios da atualidade é a incansável busca pela substituição do uso de combustíveis fósseis, que são poluentes e aumentam a concentração dos gases de efeito estufa na atmosfera, por fontes renováveis de qualidade, baixo custo e com alta densidade energética.
A energia renovável vem ocupando espaços importantes, não só na sua aplicação em diversas frentes, como também sendo escopo de diversos estudos, além de ser cada vez mais desejada pela sociedade. A qualidade de vida é proporcional ao consumo de energia elétrica. Fontes energéticas, como solar e eólica, estão ganhando grande espaço e têm se mostrado eficientes. Porém, dependem das condições climáticas que podem ser instáveis algumas vezes. Desse modo, outras fontes de energia também têm conseguido seu destaque como alternativa para o uso de combustíveis fósseis: como o uso da energia fotovoltaica e a eólica, integradas com sistema de armazenamento de energia, baterias de íon, células a combustível e as baterias de fluxo redox.
História das pilhas

O que possuem em comum o universo do setor de tratamento de superfícies, corrosão, baterias e células a combustível?
A eletroquímica: uma ciência baseada nas reações de oxirredução. Recapitulando um pouco, todo o processo de eletrodeposição envolve uma reação de oxidação (anodo), uma reação de redução (catodo – a própria peça), eletrólito (banho) e uma ligação elétrica (barramento), por aonde passam os elétrons. Utilizamos essa ciência no setor de tratamento de superfícies e corrosão.
O pai da eletroquímica foi um médico italiano, Luigi Galvani (1737-1798), que, a partir de estudos realizados em coxas de rã, descobriu que músculos e células nervosas eram capazes de produzir a eletricidade galvânica. Posteriormente, Galvani demonstrou que essa eletricidade é originária de reações químicas.
A eletroquímica iniciou antes das grandes descobertas que transformaram o mundo, como: o motor a combustão interna, patenteado em 1794 por Robert Street; a lâmpada elétrica incandescente, inventada pelo empresário americano Thomas Alva Edison (1847-1931) que, na sua vida, registrou 2.332 patentes; Humphry Davy (1778-1829), que, em 1802, construiu a primeira fonte luminosa com um filamento de platina, utilizando-se do efeito Joule.
A pilha começou com o físico italiano Alessandro Giuseppe Antonio Anastasio Volta (1745 - 1827) que, em 1800, produziu a primeira bateria. Ela era constituída de camadas alternadas de zinco, papel mata-borrão em água salgada e prata. Volta havia nascido e sido educado na região de Como, onde se tornou professor de Física na Escola Real, em 1774. Em honra ao seu trabalho no campo de eletricidade, Napoleão Bonaparte, em 1810, o nomeou conde.
A história continua com grandes nomes. Um deles, o químico e físico britânico John Frederich de Daniel (1790-1827), desenvolveu a pilha constituída de eletrodos de cobre e zinco interligados e, respectivamente, imersos em solução de Cu+2 e Zn+2. Ainda hoje, grande parte das universidades se utilizam dessa pilha em ensaios de laboratório para ensinar sobre esse assunto.
Em 1859, o físico francês Raymond Gaston Planté (1834-1889) inventou a bateria de chumbo-ácido, que se tornou o primeiro tipo de bateria recarregável a ser comercializada. Os seus princípios de funcionamento são seguidos ainda hoje.
Em 2019, três renomados pesquisadores receberam o Prêmio Nobel de Química: John Goodenough, químico Alemão, 97 anos, professor na Universidade do Texas, em Austin; M. Stanley Whittingham (1941), químico britânico de 77 anos, professor na Universidade Binghamton, em Nova York; e Akira Yoshino, químico japonês, 71 anos, professor na Universidade Meijo, em Nagoya. Essa parceria começou em 1970 quando Whittingham experimentou usar o lítio no polo negativo e titânio no polo positivo, tornando a bateria mais leve. Em 1980, Goodenough substituiu o titânio por óxido de cobalto, tornando a bateria duas vezes mais potente do que a anterior.
As primeiras baterias eram muito instáveis termodinamicamente e corriam risco de explodir. Em 1985 foi quando Yoshino resolveu esse problema. Ele substituiu o lítio metálico por um material que continha apenas os íons de lítio, reduzindo o risco de explosão ao se utilizar o grafite. Esse invento modificou o mundo, propiciou o desenvolvimento de novas tecnologias, como o celular, que antes faziam o uso das as baterias de Ni-Cd que tinham o temido efeito memória.
Hoje, a bateria de íon lítio está na Geração 2, com aproximadamente 200kW/h, graças à evolução tecnológica na área de química e materiais. Especula-se que as futuras baterias terão 900Wh/Kg (Geração 5), mas também terão metade do tamanho para uma mesma energia, pois terão a estrutura de placas bipolares. O material do anodo, hoje de carbon black, passará e ser de lítio metálico e o catodo de ar (Li-Ar). Fases intermediárias deverão ser Geração 3, com anodo de Silício com 350Wh/kg, e a geração 4, com LiS 600Wh/kg. Assim, se pode prever que, com essas futuras baterias, com a energia que um celular consome hoje, poderá se ter uma autonomia de uma semana, sendo que, atualmente, essa autonomia é de, no máximo, um dia. Mas e o custo?
Pode-se observar então que a eletroquímica é uma combinação da área de materiais, química e elétrica, além de envolver outras áreas como a física, a mecânica e a biologia, inclusive. Toda a sinergia entre distintas áreas de um desenvolvimento propicia inovações surpreendentes.
Funcionamento de bateria de fluxo (Redox flow Battery)
Uma bateria é um acumulador químico que tem a capacidade de transformar, através de reações químicas, a energia química em energia elétrica ou vice-versa. Não existe um único tipo de bateria que sirva para apenas uma aplicação em particular. Existem muitas opções, a depender dos critérios de decisão, dentre os quais podem ser citados: requisitos de performance, eficiência, limitações de espaço, infraestrutura de instalação, condições ambientais, segurança, disponibilidade e custo dos componentes, requisitos e custos de manutenção, ciclo de vida da tecnologia, profundidade de descarga, requisitos da rede/concessionária, custo das baterias, confiabilidade do fabricante e do fornecedor.
Considerando a grande variedade de tecnologias, princípios de operação e materiais que compõem as baterias, é importante distinguir dois conceitos importantes: baterias eletroquímicas e baterias de fluxo.
Nosso foco é apresentar a bateria de fluxo, pois possui uma grande similaridade com o setor de tratamento de superfícies. As baterias de fluxo armazenam energia por meio de reações entre duas soluções condutoras separadas por uma membra na semipermeável. Essa membrana permite o fluxo de íons, mas não deixa os eletrólitos se misturarem. Enquanto os íons fluem pela membrana, uma corrente elétrica que é induzida nos condutores.
Nos últimos vinte anos, diversos novos sistemas para armazenamento de energia eletroquímica foram investigados. Para alguns dos sistemas, como baterias de fluxo, o desenvolvimento chegou, agora, ao estágio pós-protótipo e início da comercialização.
A bateria de fluxo redox difere da bateria de armazenamento usual pois os eletrólitos são armazenados fora dela, o mesmo acontece com a célula a combustível, pois a energia armazenada está em cilindros de hidrogênio.
A Figura 1 mostra esquematicamente a estrutura geral para o uso de meios líquidos. As células eletroquímicas são divididas por uma membrana em duas meias células, através das quais as soluções são bombeadas em circulação. Para se atingir uma alta densidade energética, precisam ser levados em consideração: os compostos químicos eletroativos, o número de elétrons transferidos em suas reações de meia célula, seus potenciais redox padrão e a solubilidade.
Elementos químicos com pelo menos três estados de oxidação podem ser considerados espécies para ambas as meias-células, sendo que, na melhor das hipóteses, todos os três compostos são solúveis.
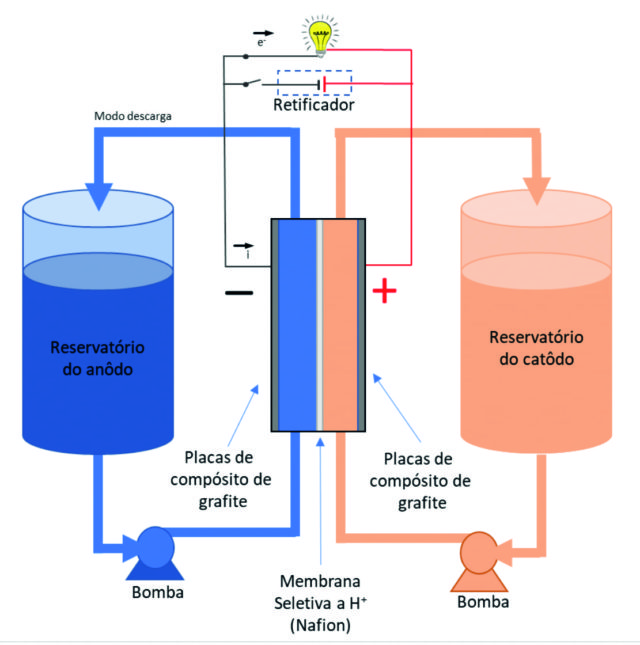 Figura 1 - Baterias de fluxo redox com eletrólitos como meio de armazenamento de energia | Fonte: Gerhard Ett
Figura 1 - Baterias de fluxo redox com eletrólitos como meio de armazenamento de energia | Fonte: Gerhard Ett
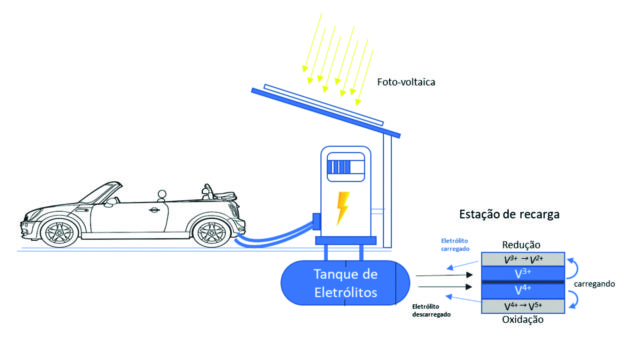 Figura 2 – Esquema de bateria de vanádio para veículo | Fonte: Gerhard Ett
Figura 2 – Esquema de bateria de vanádio para veículo | Fonte: Gerhard Ett
Aplicações
Existem diversas aplicações para as baterias de fluxo, sendo elas: fonte de alimentação ininterrupta, equipamentos de emergência e hospitalares, baterias industriais, sinalização ferroviária, estações retransmissoras, instalações militares, caminhões industriais de tração elétrica, veículos leves, instalações automáticas de baixa manutenção fora da rede, sistemas de alimentação para residências em áreas remotas.
Outra aplicação interessante para as baterias de fluxo, pode ser em áreas rurais que não apresentam sincronismo com a rede de eletricidade.
A aplicação da bateria de fluxo em veículos é uma alternativa atraente, pois permite carregar a bateria com a mesma velocidade de um tanque de combustível. Pode parecer até um pouco estranho – enche o tanque da bateria por favor?
As baterias para veículos elétricos requerem alta densidade de energia e alta eficiência de ciclo. A densidade de energia das baterias de fluxo atuais estão quase na mesma faixa que a das baterias avançadas de chumbo-ácido ou níquel-cádmio. Testes laboratoriais recentes indicam que há espaço para melhorias. Tanto a densidade de potência como a densidade de energia podem ser substancialmente aumentadas.
Atualmente, um carro elétrico superleve para duas pessoas, montado a partir de elementos disponíveis comercialmente, equipado com uma bateria de fluxo de 5 kWh, poderia percorrer uma distância de aproximadamente 150 km com uma velocidade de até 70 km/h. Aumentar o tamanho da bateria e o volume do tanque permitirá que o sistema seja empregado em veículos maiores.
Referências
BARTOLOZZI M., Development of redox flow batteries. a historical bibliography. Journal of Power Sources, 27 (1989) 219 - 234
BOCCHI N., FERRACIN L. C., BIAGGIO S. R., Pilhas e Baterias: Funcionamento e Impacto Ambiental. Química nova na escola, n. 11, Maio 2000.
NOACK J., ROZNYATOVSKAYA N., HERR T., FISCHER P., The Chemistry of Redox-Flow Batteries. Angew.Chem. Int.Ed. 2015, 54,9776–9809.
SOARES, A. B.; ALCÂNTARA, E. M.; DE ANDRADE LIMA, L. R. P, Baterias de Vanádio para Estocagem de Energia Limpa, XXVIII Encontro Nacional de Tratamento de Minérios e Metalurgia Extrativa: Belo Horizonte, 2019.
TICIANELLI, E. A.; GONZALES, E. R.; Eletroquímica, Princípios e aplicações, 2ª edição, Edusp: São Paulo, 2005.
Contato: gerhard@fei.edu.br
Acesse a Publicação original na revista Tratamento de Superfície | Edição 219 - Abril 2020











